单细胞测序后的RNAscope验证实例——2019年代表性文章解读
单细胞RNA测序(single-cell RNA sequencing,scRNA-seq)技术作为一项革命性工具,在单细胞水平上对转录组进行分析,已经被广泛用于多个方面的生物医学研究,包括肿瘤异质性研究、新细胞类型的鉴定、组织发育与细胞分化过程研究和基因调控网络研究等。通过scRNA-seq获得高通量的单细胞转录组数据后,利用原位组织学验证是目前流行的研究策略,也是对单细胞测序结果筛选出的有价值分子的空间分布定位回溯以及结果真实性的验证。
由于这其中的很多原位待检测分子属于新发现的靶点,缺乏有效的免疫组化抗体;也存在一些例如GPCR,离子通道这类无法制备免疫组化抗体的靶点;而对于分泌型细胞因子由于其合成后被第一时间排出到细胞外,故无法通过免疫组化方式定位分泌细胞;包括长链非编码RNA在内的一些靶点则不可能使用免疫组化的原位检测方法进行靶点追踪。对于以上的这些分子的原位检测,目前通常使用RNAscope技术进行解决。RNAscope技术以其具有高度敏感性和特异性、单分子可视化、多通道靶点同时检测(在一张切片上同时检测12个靶点)等特有的优势,已经广泛应用于原位验证单细胞转录组学的结果。本文将以2019年使用RNAscope技术验证单细胞转录组学结果发表的一些代表性文章为例为大家介绍相关研究进展。

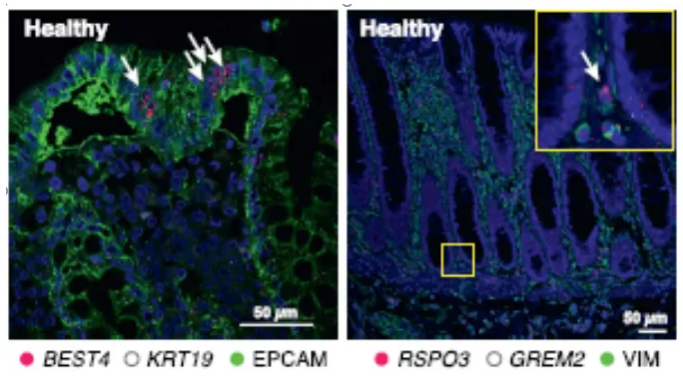
2019年来自麻省理工学院和哈佛大学的研究学者在《Cell》杂志上发表的一篇研究论文揭示了溃疡性结肠炎的耐药机制[1]。在这项研究中,研究人员利用scRNA-seq从18例溃疡性结肠炎(UC)患者和12例健康人的结肠粘膜中生成了366,650个细胞的图谱,以此来了解细胞类型特异性和作用途径,揭示了51个上皮细胞、基质细胞和免疫细胞亚群。在UC患者中,肿瘤坏死因子(TNF)蛋白水平较高,抗TNF药物可减轻炎症并治愈许多患者的组织。然而,大约30%的患者对治疗没有响应,而那些有响应的患者随着时间的推移变得具有耐药性。研究人员此前已经确定了耐药性相关的基因,但尚不清楚结肠中哪些特定的细胞类型表达了这些基因。在此次研究中,单细胞测序数据分析表明BEST4 +肠上皮细胞,RSPO3+成纤维细胞,IL13RA2 + IL11 +炎性成纤维细胞等细胞亚群与抗肿瘤坏死因子(TNF)治疗的抗性有关。研究人员进一步利用RNAscope原位杂交结合免疫荧光验证并从空间定位上展现了单细胞测序的主要发现。下图为使用RNAscope检测到的健康人BEST4 +肠上皮细胞(左图,红色表示RNAscope检测到的BEST4的RNA信号)与RSPO3+成纤维细胞(右图,红色表示RNAscope检测到的RSPO3的RNA信号)在肠道中的定位情况。
尽管大多数成纤维细胞亚群同时存在于健康个体和UC患者中,但一类称之为炎症相关成纤维细胞(IAFs)的亚群在一些病人的炎症组织中表达扩大了189倍。IAFs富含许多与结肠炎、纤维化和癌症相关的基因,包括IL11、IL24和IL13RA2。研究人员就利用RNAscope原位杂交技术检测了健康组织与炎症组织中的炎症相关成纤维细胞的特征基因表达,证实了表达IL13RA2的炎症相关成纤维细胞在炎症组织中的表达远高于正常组织(见下图,红色为RNAscope检测到的IL13RA2的RNA信号)。

除了炎症相关成纤维细胞外,单细胞测序分析结果也表明在UC患者样本中,同时表达CD8和IL-17的T细胞所占比例更高。在进一步的RNAscope原位杂交验证中发现CD4+与CD4- T细胞都共表达CD8与IL17A(见下图,红色为RNAscope检测到的IL17A的RNA信号)。其中CD4+ CD8+IL17A+ T细胞是一类新发现的细胞亚群,在炎症组织中,CD4+ CD8+IL17A+ T细胞的数量明显增加。

肿瘤坏死因子(TNF)的表达在UC患者中发生改变,Treg细胞从健康组织向炎症组织扩展,是炎症过程中TNF的主要来源。在炎症组织中,TNF在Treg细胞中诱导表达。研究人员利用RNAscope原位杂交检测了IL10,TNFA以及Treg细胞标志基因FOXP3的表达,验证了在炎症组织中Treg细胞中TNF的表达显著上升(见下图,白色为RNAscope检测到的FOXP3的RNA信号,绿色为RNAscope检测到的IL10的RNA信号,红色为RNAscope检测到的TNFA的RNA信号)。

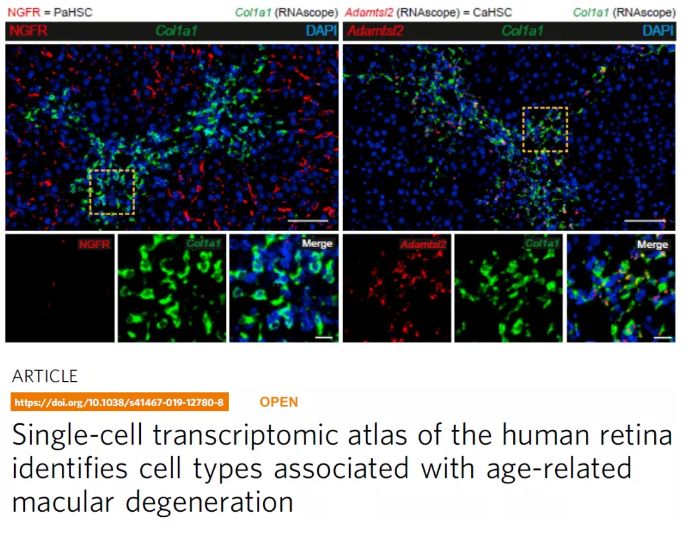
反复肝损伤导致进行性纤维化,破坏肝脏结构,再生潜能以及肝功能。肝星状细胞(HSCs)是纤维化过程中病理基质的主要来源。2019年英国爱丁堡大学Dobie等人在《Cell Reports》发表的一篇研究论文将健康小鼠与肝纤维化小鼠的肝间质细胞进行单细胞测序分析,揭示了肝小叶中HSCs的空间和功能分区,鉴定了两种有独特基因表达特征的不同HSCs细胞亚群[2],一种称为门静脉相关HSCs(PaHSCs),另一种称为中央静脉相关HSCs(CaHSCs)。为了确定这两种HSCs亚群的空间分布,研究人员进一步利用RNAscope原位杂交技术检测了PaHSCs的标志基因NGFR与CaHSCs的标志基因Adamtsl2的表达(见下图,左图红色为RNAscope检测到的NGFR的RNA信号,右图红色为RNAscope检测到的Adamtsl2的RNA信号)。通过与免疫荧光技术结合,证实了肝小叶中NGFR+ HSCs与门静脉相关肝细胞(E-cadherin+)共定位,而Adamtsl2+ HSCs与中央静脉相关肝细胞(Cyp2e1+)共定位。

急性CCL4诱导的肝损伤的特征是HSCs显著增值以及被激活为肝小叶中心区域产生胶原的肌成纤维细胞。为了进一步研究PaHSCs和CaHSCs分化为致病性胶原产生细胞的动态,研究人员利用单细胞测序分析了急性CCL4诱导的肝损伤小鼠模型的HSCs。结果表明PaHSCs和CaHSCs两个细胞亚群均表达细胞增殖标志物ki67,而只有CaHSCs中纤维化相关的基因表达显著升高。利用RNAscope原位杂交结合免疫荧光证实了CaHSCs是在肝小叶中心性损伤导致的纤维化过程中产生病原胶质的主要细胞(见下图,左图红色为RNAscope检测到的NGFR的RNA信号,右图红色为RNAscope检测到的Adamtsl2的RNA信号)。
年龄相关性黄斑变性(AMD)是致盲的主要原因之一,然而,由于该疾病的遗传复杂性,使得确定与AMD相关的细胞类型一直是一个挑战。2019年来自麻省理工学院,哈佛大学与剑桥大学的研究人员发表在《Nature Communication》上的一篇研究论文对人视网膜进行了单细胞测序分析,报告了人类视网膜的第一个单细胞转录图谱[3]。通过对scRNA-seq数据进行分析,研究人员确定了所有主要的视网膜细胞类型,以及它们相应的基因表达特征。研究人员通过scRNA-seq首先鉴定了3种不同的大胶质细胞亚群,表明人类视网膜神经胶质比以前认为的要多样化。3种大胶质细胞亚群分别特异性表达FOS,FTL, COL4A3。研究人员进一步使用RNAscope原位杂交技术验证并确定了新鉴定的3种大胶质细胞亚群的空间分布(见下图,A图红色为RNAscope检测到的FOS的RNA信号,黄色为RNAscope检测到的FTL的RNA信号;B图红色为RNAscope检测到的COL4A3的RNA信号,黄色为RNAscope检测到的FTL的RNA信号;C图红色为RNAscope检测到的COL4A3的RNA信号,黄色为RNAscope检测到的FOS的RNA信号)。
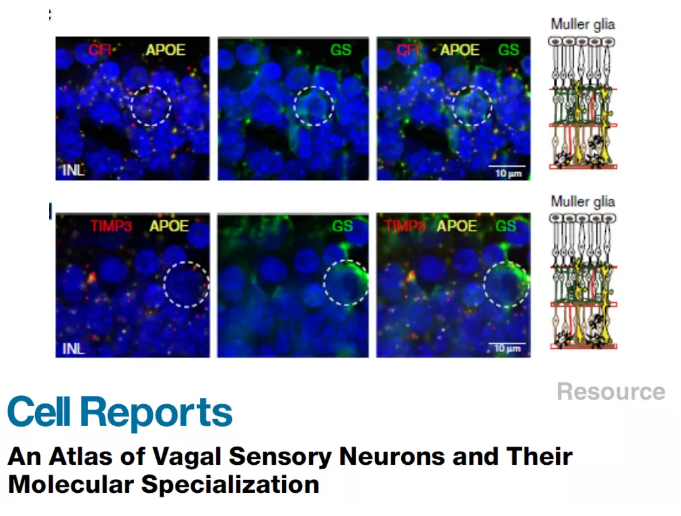
研究人员获得的人视网膜单细胞转录组图谱将AMD遗传风险与细胞类型特异性表达模式相关联,发现Müller胶质细胞和星形胶质细胞特异表达AMD相关基因,包括CFI, TIMP3, VEGFA与COL4A3。研究人员进一步使用RNAscope技术结合免疫荧光原位验证了在Müller胶质细胞和星形胶质细胞中表达的AMD相关基因(见下图,A图红色为RNAscope检测到的CFI的RNA信号,B图红色为RNAscope检测到的TIMP3的RNA信号;黄色为RNAscope检测到的Müller胶质细胞标志物APOE的RNA信号)。该部分结果为黄斑变性的分子机制研究提供了原位空间细胞分布信息。
迷走神经感觉神经元是控制器官功能所必需的,但目前对所涉及的神经元类型的复杂性仍缺乏了解。2019年来自瑞典卡罗林斯卡研究所的研究人员通过scRNA-seq对颈静脉和结节性迷走神经节的神经元类型进行了全面的鉴定和分类,鉴定出6种颈静脉神经元和18种节状神经元[4]。小鼠迷走神经神经节复合体包括神经嵴衍生的颈静脉神经节和基板来源的节状神经节,转录因子Phox2b可作为节状神经元的标志物,另一种转录因子Prdm12可作为颈静脉神经元的标志物。在此研究中,单细胞测序鉴定的24个迷走神经节神经元细胞群中有18个表达Phox2b,其余6个表达Prdm12。研究人员使用RNAscope技术进一步地量化分析了分别表达Phox2b与Prdm12的神经元的相对比例(见下图,红色为RNAscope检测到的Phox2b的RNA信号,绿色为RNAscope检测到的Prdm12的RNA信号),结果表明在469个神经元中,386个表达Phox2b,83个表达Prdm12。与单细胞测序结果一致,表明迷走神经神经节复合体由约85%的节状神经元与约15%的颈静脉神经元组成。

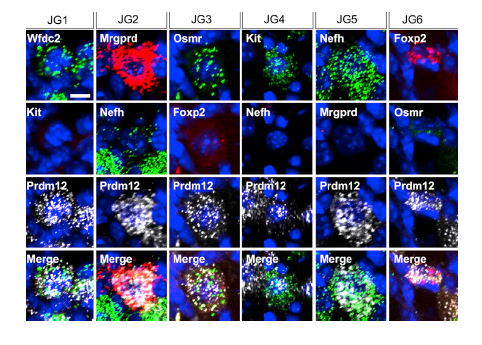
scRNA-seq鉴定的6种颈静脉神经元分别命名为JG1-JG6。6种颈静脉神经元分别有相应的特异性表达基因,JG1为Wfdc2,JG2为Mrgprd,JG3为Osmr,JG4为Kit,JG5为Nefh,JG6为Foxp2。为了证实这6种颈静脉神经元在体内的分布,研究人员用RNAscope多重荧光原位杂交进行了验证,针对不同的神经元亚群,分别设计了两种探针,一种是每个神经元亚群对应的特异性表达基因,一种是颈静脉神经元标志基因Prdm12,两种探针联合使用,原位鉴定6种不同的颈静脉神经元(见下图,RNAscope检测到的Wfdc2,Osmr,Kit,Nefh的RNA信号为绿色,RNAscope检测到的Mrgprd,Foxp2的RNA信号为红色,白色为RNAscope检测到的Prdm12的RNA信号)。
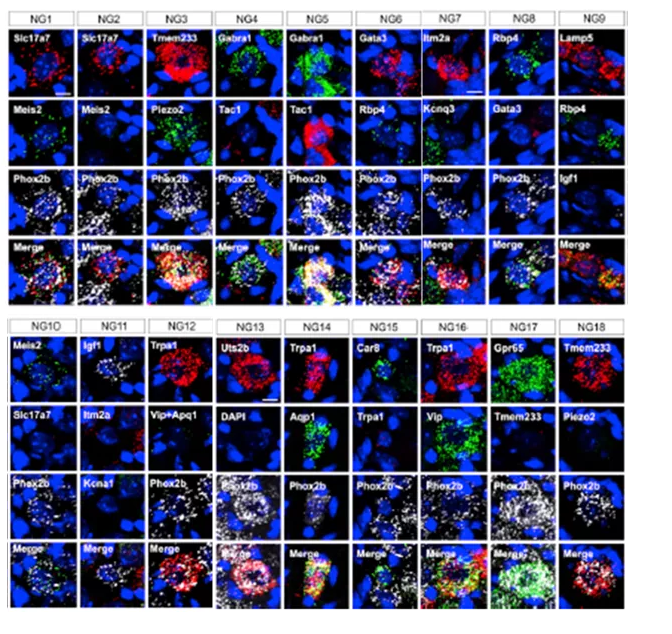
scRNA-seq鉴定的18种节状神经元分别命名为NG1-NG18,所有节状神经元类型都有独特的基因表达模式。研究人员用RNAscope原位杂交的方法检测18种节状神经元的特征基因以及所有节状神经元的共同标志基因Phox2b的表达,从空间定位上鉴定了18种不同的节状神经元类型(见下图,白色为RNAscope检测到的Phox2b的RNA信号,绿色和红色分别为RNAscope检测到的18种节状神经元的特征基因的RNA信号)。从而对测序结果进行了细胞和原位空间分布的验证。
References
1. Christopher S Smillie, Moshe Biton, Jose Ordovas-Montanes, et al. Intra- And Inter-cellular Rewiring of the Human Colon During Ulcerative Colitis. Cell. 2019; 178(3):714-730.
2. Ross Dobie, John R Wilson-Kanamori, Beth E P Henderson, et al. Single-Cell Transcriptomics Uncovers Zonation of Function in the Mesenchyme During Liver Fibrosis. Cell Rep. 2019; 29(7):1832-1847.
3. Madhvi Menon, Shahin Mohammadi, Jose Davila-Velderrain, et al. Single-cell Transcriptomic Atlas of the Human Retina Identifies Cell Types Associated With Age-Related Macular Degeneration. Nat Commun. 2019; 10(1):4902.
4. Jussi Kupari, Martin Häring, Eneritz Agirre, et al. An Atlas of Vagal Sensory Neurons and Their Molecular Specialization. Cell Rep. 2019; 27(8):2508-2523.
- 上一篇:今天你扫码了吗?扫码验真假,码上好礼送不停! 2020/8/4
- 下一篇:APExBIO分子库夏季大促销——4折起! 2020/7/9
